Lewodopa – 12 porad neurologa Erica Ahlskoga
Stworzona po raz pierwszy w 1911 przez Kazimierza Funka lewodopa potrzebowała bez mała pół wieku by połączyć ją z parkinsonizmem, czyli nieco szerszym pojęciem chorobowym obejmującym m.in. chorobę Parkinsona. Z początków karbidopy/lewodopy, którą w skrócie będę nazywał L-dopą, najbardziej znana jest historia spisana przez neurologa Olivera Sack’sa. Jego wspomnienia z leczenia ludzi dotkniętych śpiączkowym zapaleniem mózgu, które nawiedziło Europę i Stany Zjednoczone (1917-1926), zostały wydane a następnie zekranizowane pod tym samym tytułem „Przebudzenia”.
Minęło około osiemdziesiąt lat, odkąd lewodopa jest w powszechnym użyciu i choć widać na horyzoncie pierwsze jaskółki nadchodzących zmian to lek ten wciąż jest podstawą leczenia. Dlatego poniżej znajduje się 12 spostrzeżeń odnośnie jej zastosowania w leczeniu choroby Parkinsona autorstwa neurologa J. Eric Ahlskog’a. W 2011 roku zdecydował się on podsumować swoją blisko 30-letnią praktykę w artykule pt.: „Tańsze, prostsze i lepsze porady odnośnie leczenia seniorów z chorobą Parkinsona”. Co prawda kierowane są one do lekarzy, ale nie zaszkodzi się z nimi zaznajomić choćby dlatego żeby lepiej zrozumieć chorobę i jej leczenie.
1. Leki nie spowalniają postępu choroby
Ahlskog w swoim pierwszym punkcie powołuje się na raport sporządzony dla Amerykańskiej Akademii Neurologii z 2006 roku, którego konkluzję można przedstawić w sześciu punktach
1. Lewodopa zdaje się nie przyspieszać neurodegeneracji
2. Żaden lek nie wykazał właściwości ochronnych na układ nerwowy
3. Nie ma żadnych dowodów na to, że witaminy czy suplementy diety poprawiają funkcje motoryczne
4. Ćwiczenia fizyczne mogą korzystnie wpłynąć na funkcje motoryczne
5. Terapia mowy może poprawić głośność
6. Terapie manualne nie są pomocne przy symptomach motorycznych
Ahlskog podkreśla także, że co prawda później ukazał się artykuł w The New England Journal of Medicine, wysoko cenionym czasopiśmie medycznym, dowodzący spowalniającego efektu rasagiliny, to znajdujące się w tym badaniu czynniki mogły wpłynąć na ostateczny wynik. Owo badanie obejmowało pokaźną liczbę 1176 ochotników i trwało 72 tygodnie. Na podstawie rezultatów wywnioskowano, że 1mg rasagiliny dziennie, spowalnia procesy neurodegeneracyjne we wczesnej fazie choroby Parkinsona (rys.1). Dodam jedynie, że raport, z którego pochodzą owe wnioski także został skrytykowany za niedostateczny opis metody i szczegółów mogących potwierdzić rzetelność konkluzji.
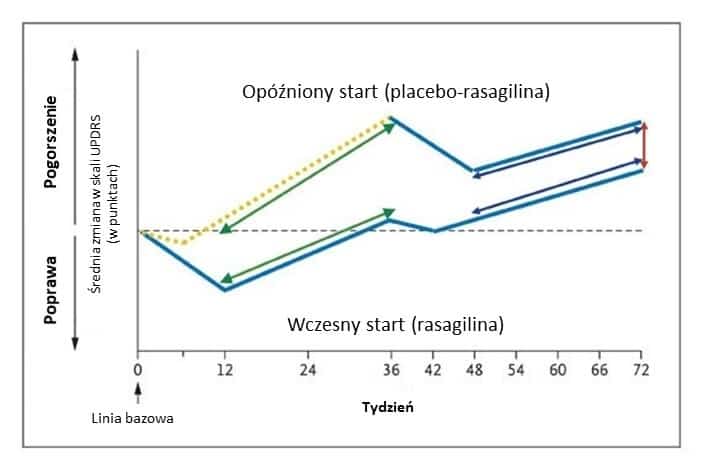 Rys.1. Różnica po 72 tygodniach miedzy grupą placebo-rasagilinę a biorącą rasagilinę cały czas
Rys.1. Różnica po 72 tygodniach miedzy grupą placebo-rasagilinę a biorącą rasagilinę cały czas
Źródło: Olanow C., (2009) “New England Journal of Medicine”
2. Dopamina nadal jest podstawą leczenia
Obecnie wiadomo, że choroba Parkinsona (chP) to znacznie więcej niż utrata dopaminy. Inne układy neuroprzekaźnikowe dotknięte są nie tylko w późnym, ale także we wczesnym stadium, poprzedzającym objawy motoryczne. Wczesne objawy, takie jak zaburzenia snu fazy REM, utrata węchu, niepokój lub zaparcia, mogą pojawić się na 20 lub więcej lat przed rozpoznaniem chP. Zaś charakterystyczny przebieg, obejmujący dziesięciolecia, został sformalizowany w schemacie oceny Braaka. Pomimo, że chP jest czymś więcej niż stanem niedoboru dopaminy, większość korzyści terapeutycznych osiąga się poprzez przywrócenie neurotransmisji dopaminy w mózgu.
3. Carbidopa (benserazyd) + lewodopa najbardziej efektywna terapia początkowa
Pomimo upływu lat pozostaje ona najskuteczniejszym rozwiązaniem, ale czasami zaleca się stosowanie nowych leków na chP jako początek leczenia, są one jednak droższe i przynoszą seniorom nie tak wiele korzyści.
Do agonistów (wzmacniaczy) dopaminy, które stanowią alternatywę dla L-dopy w początkowym stadium, zalicza się m.in.: pramipeksol czy ropinirol. Są one jednak mniej skuteczne, a ponadto mają uciążliwe działania niepożądane takie jak: senność, zachowania patologiczne (hazard, promiskuityzm), 3-krotnie zwiększa się ryzyko wystąpienia halucynacji a niekiedy mogą wystąpić masywne obrzęki nóg. Głównym argumentem przemawiającym za tymi agonistami jest zmniejszenie ryzyka dyskinez (niekontrolowanych ruchów) i wahania funkcji ruchowych, ale we wczesnych latach choroby Parkinsona nie są to częste problemy. Sytuacja ma się odwrotnie u ludzi młodych zdiagnozowanych przed 40-tym rokiem życia. W ich przypadku jest prawie pewne, że w ciągu 5 lat od rozpoczęcia leczenia L-dopą pojawią się dyskinezy.
4. Nie ma co oszczędzać leku na potem
L-dopa jest często niezmiernie skuteczna na początku i daje stabilną (długotrwałą) odpowiedź. Jednak wraz z upływem czasu odpowiedź ta staje się mniej satysfakcjonująca a także zaczynają występować dyskinezy. Dlatego niektórzy postulują, że poprzez późniejsze rozpoczęcie terapii można zachować korzystne działanie leku, brak jest jednak na to przekonujących dowodów.
W rzeczywistości odroczenie leczenia może mieć długoterminowe, szkodliwe konsekwencje. Objawy choroby mogą bowiem ograniczyć sprawność fizyczną, która raz utracona jest trudna do odzyskania. A co ważniejsze pojawiająca się literatura sugeruje, że to właśnie aktywność fizyczna może mieć zarówno ochronny jak i neuroplastyczny wpływ na układ nerwowy.
5. Generyczna L-dopa o natychmiastowym uwalnianiu to doskonały wybór
Na opakowaniu widnieją dwie liczby (rys. 2), gdzie mniejsza określa ilość benserazydu bądź karbidopy składnika, który chroni przed nudnościami. Stąd preferuje się jej większą zawartość, pomimo że jest ona nieco droższa, ale jeśli nudności nie występują, można pozostać przy tańszej opcji.

Preparat o kontrolowanym uwalnianiu np.: Madopar® HBS ma mniejszą biodostępność niż lek o natychmiastowym uwalnianiu; generuje bardziej nieregularną odpowiedź i znacznie wolniej się „uruchamia”. Jest również droższy niż preparat o natychmiastowym uwalnianiu i ma złożone interakcje z pożywieniem stąd jego rola w praktyce jest dość ograniczona.
Rys.2. Przykładowe opakowanie leku Madopar
Źródło: https://www.roche.com/products.htm
6. L-dopę należy przyjmować na pusty żołądek
Białka w diecie uwalniają aminokwasy, które konkurują z lewodopą o transport przez barierę krew-mózg. Ten układ transportowy może zostać łatwo nasycony, dlatego podawanie leku z posiłkami znacznie zmniejsza jego skuteczność. Aby upewnić się, że przejście lewodopy przez barierę krew-mózg nie jest zaburzone, pacjentom należy zalecić przyjmowanie dawek na około godzinę przed i na dwie lub więcej godzin po jedzeniu. Jednak w przypadku pacjentów, którzy odczuwają nudności, dopuszczalne jest przyjmowanie leku z suchym pieczywem, krakersami sodowymi, porcją banana lub innym produktem niebiałkowym.
7. Dawka leku ma być właściwa dla ciebie
Chociaż niektórzy opowiadają się za utrzymaniem jak najniższych dawek lewodopy, to nie ma dowodów, że strategia ta przynosi długoterminowe korzyści. Może to natomiast skutkować rychłym obniżeniem sprawności fizycznej a o konsekwencjach takiego stanu rzeczy była już mowa.
Rozpoczynając leczenia L-dopą zwykle podaje się jedną bądź pół tabletki 3 razy dziennie. Doktor Ahlskog woli zaczynać od całych tabletek, ponieważ są one zwykle dobrze tolerowane a w ten sposób szybciej osiąga się odpowiednie stężenie leku.
Celem leczenia jest uchwycenie najlepszej odpowiedzi lewodopy, która pozwoli pacjentowi być aktywnym i w pełni zaangażowanym w życie, w tym także w ćwiczenia. Mając to na uwadze, stężenie leku można co tydzień zwiększać o pół tabletki przy każdej dawce. W miarę zwiększania dawki symptomy motoryczne winny zanikać na tyle, aby umożliwić pacjentom normalne funkcjonowanie we wszystkich aspektach ich życia. Punktem przesilenia, jeśli chodzi o bilans zysków i strat jest dawka 2,5 tabletki (25/100 carbidopa/lewodopa) na jeden raz, ale okazjonalnie pacjenci wymagają 3 tabletek. Innymi słowy, wyższe dawki takie jak 4-5 tabletek, stanowiące sumarycznie 400-500mg lewodopy brane na raz, nie gwarantują przyrostowej poprawy symptomów. Podsumowując, optymalna indywidualna dawka wynosi od 1 do 3 tabletek przyjmowanych 3 razy dziennie we wczesnym stadium choroby.
8. Wczesne skutki uboczne to przede wszystkim nudności i niedociśnienie ortostatyczne
Tytułowe działania niepożądane pojawiają się głównie na początku terapii. Występujące nudności są zwykle łagodne i ustępują w trakcie dalszego leczenia. Ich powodem jest to, że krążąca dopamina przekracza barierę krew-mózg w regionie pnia mózgu, gdzie znajduje się centrum kontrolujące nudności a zwiększone stężenie dopaminy stymuluje owo centrum. Tak więc nudności nie są oznaką patologii żołądkowo-jelitowej, takiej jak zapalenie żołądka lub wrzody.
Oczywiście nudności związanych z lewodopą nie należy leczyć lekami blokującymi dopaminę, takimi jak metoklopramid (Metoclopramidum Polpharma®) lub prochlorperazyna (Chloropernazinum®).
Przykłady leków przeciwwymiotnych, które można podawać pacjentom z chorobą Parkinsona to trimetobenzamid (Torecane®) i ondansetron (Zofran®). Można tu jeszcze dodać domperidone (Oroperidys®), ten co prawda blokuje receptory dopaminy, ale nie przenika przez barierę krew-mózg.
Choroba Parkinsona wiąże się z problemami autonomicznego układu nerwowego a jednym z nich jest niedociśnienie ortostatyczne. Problem, może być spotęgowany przez przyjmowanie innych leków np.: na nadciśnienie, na powiększoną prostatę (np. Tamsulosyna – Tamiron®) lub leki moczopędne. Dlatego przed rozpoczęciem leczenia należy sprawdzić czy wartość skurczowa (ta wyższa) ciśnienia krwi w pozycji stojącej jest wyższa niż 100 mmHg. Ponadto pacjenci z niskim ciśnieniem krwi powinni się regularnie monitorować a wartość skurczowa nie powinna spadać poniżej 90 mmHg. Gdy jednak problem niedociśnienia ortostatycznego się pojawi to są sposoby, aby radzić sobie z nim. (link)
9. Zmiana działania leku
W ciągu pierwszych kilku lat choroby odpowiedź na L-dopę jest stabilna i niezmienna w ciągu dnia. Jednak z czasem działanie leku jest krótsze i co raz bardziej ograniczone, wówczas następują wahania. Przykładowo, rankiem mogą wystąpić trudności z chodzeniem a normalizacja następuje dopiero po około godziny od pierwszej dawki. Zaś czas działania może trwać od 1 do 6 godzin po czym problemy z poruszaniem się powracają.
W takich przypadkach rzadko korzystne jest stosowanie większych indywidualnych dawek lewodopy, gdyż zwiększenie dawki nie przekłada się na dłuższe odpowiedzi. Odpowiednią strategią jest określenie czasu działania leku i dostosowanie odstępów między dawkami tak by uzyskać optymalny efekt. Liczba dawek lub tabletek dziennie powinna być dostoswana odpowiednio do potrzeb pacjenta.
10. Dyskinezy lewodopy są często łagodne i uleczalne
Mniej więcej w tym samym czasie, gdy odpowiedź na lewodopę słabnie, mogą wystąpić ruchy hiperkinetyczne nazywane dyskinezami. Wiązane jest to z wahaniami poziomu dopaminy i tak jak jej niedostatek przekłada się na takie problemy jak: spowolnienie ruchowe czy dystonie, zbyt duże stężenie wywołuje nadmierne ruchy, czyli dyskinezy (Rys.3).
Video 1. Przykład zaawansowanej dyskinezji i efekt wstrzykniecie apomorfiny
Źródło: Neurology Journal [https://www.youtube.com/watch?v=vSVPMA55t_0]
Dyskineza charakteryzuje się swobodnymi, płynnymi lub tanecznymi ruchami kończyny, tułowia, głowy, szyi lub ich kombinacją. Różni się to od zwykłej dystonii, która często jest bolesna, i przypomina skurcze. Klasyczna dystonia, zwłaszcza bolesna, zazwyczaj reprezentuje stan niedostatecznej dawki leku. Typowym przykładem jest dystoniczne podkręcenie palca lub odwrócenie stopy (Rys.3). Jest to problem często doświadczany przez pacjentów, który sygnalizuje zanikający efekt leku lub nieodpowiednią jego dawkę.
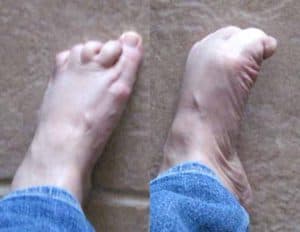
Rys.3. Przykład dystonii
Źródło: Yuma B.: “Parkinson’s Humor”
[www.parkinsonshumor.blogspot.com]
Ponieważ dyskinezy to odpowiedź na nadmierne uzupełnienie dopaminy, można je ograniczyć poprzez zmniejszenie indywidualnych dawek leku. Takie leczenie, poprzez redukcję lewodopy wiąże się jednak z ryzykiem nawrotu symptomów. Może to być tym bardziej skomplikowane faktem, że niektórzy pacjenci mają wąskie okno terapeutyczne, czyli wartość dawki, w której powinni przebywać. W takim przypadku warto spróbować starego leku amantadyny, która dobrze się sprawdza w łagodzeniu dyskinez. Zaleca się 100 mg amantadyny dwa razy dziennie co w razie potrzeby można zwiększyć do 3-4 razy dziennie. Należy jednak wiedzieć, że u podatnych osób amantadyna może przyczyniać się do dezorientacji lub omamów. Ponadto często występuje siność siatkowata, która nie jest groźna i nie powinna nas niepokoić.
11. Lęk, akatyzja i napady paniki to część choroby
Choroba Parkinsona wykracza daleko poza obszar objawów motorycznych i problemy takie jak: lęk, przymus bycia w ciągłym ruchu (akatyzja) czy panika także mogą odzwierciedlać niedostateczne uzupełnienie dopaminy. Dla niektórych pacjentów mogą to być najbardziej uciążliwe symptomy. Tak więc narastający i zanikający niepokój często odzwierciedla stan nieadekwatnego poziomu leku i wymaga dostosowania odstępów między dawkami.
12. Bezsenność w chorobie Parkinsona
U pacjentów z chorobą Parkinsona występują także trudności z zasypianiem lub spaniem a to z powodu takich objawów jak: akatyzja, sztywność, niemożność przewrócenia się w łóżku i drżenie. Taka bezsenność zazwyczaj odpowiada na uzupełnienie dopaminy. Wśród pacjentów z niedawno rozpoznaną chP dzienne dawki leku mogą leczyć bezsenność. Lecz w sytuacji, gdy choroba jest bardziej zaawansowana konieczne jest podawanie leku przed snem lub nawet w nocy, przy czym dawka ta powinna być taka sama jak ta w dzień.
Należy zaznaczyć, że nie wszystkie zaburzenia snu wiążą się z niedoborem dopaminy. Zaburzenia snu fazy REM i związane z tym rzucanie się bądź nawet odgrywanie scen przez sen są głównym objawem demencji z ciałami Lewy’ego. Symptom ten może wyprzedzać chorobę o wiele lat i zaleczany jest dawką benzodiazepiny (klonazepamu) braną przed snem.
Zawarte w tym artykule informacje mają na celu przybliżyć podstawowe strategie leczenia lewodopą oraz problemy związane z ubytkiem dopaminy, których powiązania nie są aż tak oczywiste. Mam nadzieje, że pomoże to w zrozumieniu choroby i pozwoli efektywniej wykorzystać czas wizyty u neurologa, pytając go o konkretne rozwiązania problemów.
Bibliografia
Ahlskog, J. E. (2011, December). Cheaper, simpler, and better: tips for treating seniors with Parkinson disease. In Mayo Clinic Proceedings (Vol. 86, No. 12, pp. 1211-1216). Elsevier.
Group, P. S. (2000). Pramipexole vs levodopa as initial treatment for Parkinson disease: a randomized controlled trial. Jama, 284(15), 1931-1938
Olanow C. W. Rascol O. Hauser R. et al. (2009). A double-blind, delayed-start trial of rasagiline in Parkinson’s disease. New England Journal of Medicine, 361(13), 1268-1278.
Suchowersky O. Gronseth G. Perlmutter J. et al. (2006). Practice parameter: neuroprotective strategies and alternative therapies for Parkinson disease (an evidence-based review). American Academy of Neurology.