Komórki macierzyste w chorobie Parkinsona
Komórki macierzyste w chorobie Parkinsona

Wątek leczenia choroby Parkinsona (chP) komórkami macierzystymi pojawia się co raz częściej wśród osób zainteresowanych nowymi metodami leczenia. Jednym z czołowych badaczy w tej dziedzinie jest Roger Barker, profesor na wydziale neurobiologii klinicznej uniwersytetu Cambridge, kierownik centrum badawczego John van Geest Centre for Brain Repair, który często wypowiada się dla fundacji Cure Parkinson’s Trust. Profesor Barker zajmuje się chorobami neurodegeneracyjnymi przeszło 30 lat i to na jego wypowiedziach oparty jest ten artykuł.
Wbrew często wyrażanym nadziejom, terapia komórkami macierzystymi z założenia nie ma wyleczyć z choroby Parkinsona. Jej cel jest znacznie skromniejszy, a mianowicie odbudowa utraconych komórek w konkretnym miejscu nigrostriatalnego szlaku dopaminergicznego (Rys 1.). W założeniu pozwoli to zniwelować symptomy choroby i funkcjonować bez potrzeby zażywania leków czy dalszych interwencji chirurgicznych przez okres co najmniej dekady. Główną zaletą tej terapii będzie brak występowania skutków ubocznych, które z czasem pojawiają się przy leczeniu farmakologicznym. Jednak pomimo obiecujących rezultatów przed naukowcami jest wciąż sporo wyzwań aby myśleć o wprowadzeniu tego rozwiązania na rynek.
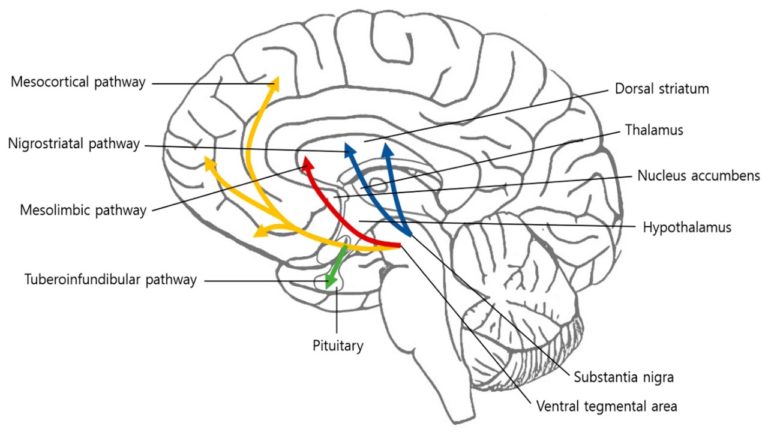
Rys. 1. Ścieżki dopaminergiczna i podstawowe struktury
Czym jest komórka macierzysta
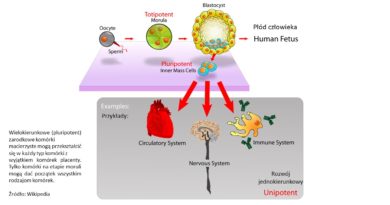
Komórka macierzysta charakteryzuje się zdolnością do replikacji, praktycznie w nieskończoność oraz potencjałem do przekształcenia się w komórki wyspecjalizowane, czyli budujące tkanki i organy. Jednak nie każda komórka macierzysta ma taki sam potencjał, z tego względu wyróżnia się ich kilka rodzajów:
• Totipotencjalne: powstają w efekcie zapłodnienia dając początek każdej naszej komórce a także odpowiadają za wytworzenie łożyska
• Pluripotencjalne: dają początek wszystkim komórkom w organizmie człowieka.
• Multipotencjalne: mogą się wyspecjalizować w obrębie jednej rodziny komórek np. w obrębie komórek krwi gdzie dają początek m.in. limfocytom, neutrofilom czy monocytom
• Unipotencjalne: dają początek tylko jednemu rodzajowi komórek
To nie jest nowy pomysł
Terapia komórkami macierzystymi nie jest bynajmniej nowym pomysłem i jeśli chodzi o próby jej zastosowania w chP to początku należy szukać w latach 70’tych. Wówczas Anders Björkland opracował technikę wszczepiania komórek nerwowych w mózgi zwierząt, u których wywołano ubytki imitujące zmiany występujące w chP. W tym przypadku nie mówimy jeszcze o komórkach macierzystych, ale o nie całkiem wykształconych komórkach nerwowych, pobranych od bardzo młodych osobników. Komórki okazały się być zdolne do zintegrowania z systemem nerwowym osobnika, u którego wywołano ubytki.
W przypadku ludzi problem rozpoczyna się od ustalenia odpowiedniego miejsca, z którego moglibyśmy czerpać materiał do przeszczepu. Pierwsze próby polegały na pobraniu komórek produkujących dopaminę znajdujących się w nadnerczach. Komórki takie występują bowiem nie tylko w istocie czarnej śródmózgowia (Substantia Nigra), ale również w korze nadnerczy, niewielkich organów umieszczonych nad nerkami, czy arterii szyjnej a dokładniej w kłębku szyjnym (łac. glomus caroticum). Pierwsza udana operacja, miała miejsce w Meksyku w latach ’80-tych, co zaowocowało podjęciem podobnych prób w Stanach Zjednoczonych. Dopiero po tym jak wykonano szereg kolejnych zabiegów okazało się, że przeszczepione komórki nie przyjmują się i albo umierają albo powodują komplikacje, z których najczęstszym były dyskinezy. Gdy fala początkowego entuzjazmu a później rozczarowania opadła, wyszło na jaw że pozytywne wyniki pierwszej operacji zostały zafałszowane.
Komórki pobierane z płodu
Historia bardziej współczesna to próba wykorzystania młodszych a przez to nie całkiem ukształtowanych komórek, które może dostarczyć zabieg aborcji. Zatem ponownie nie była to próba wszczepienia komórek macierzystych a młodych komórek dopaminergicznych. Pomimo, że pierwsze pozytywne rezultaty przeszczepu u zwierząt uzyskano już na początku lat ‘70-tych to jednak próby na ochotnikach miały miejsce dopiero 15 lat później. Pierwsze wyniki generalnie były umiarkowane, ale w niektórych przypadkach pozwalały być rzeczywiście optymistycznymi. I tak w pierwszym badaniu przeprowadzonym w Europie, u dwóch z 18 uczestników odnotowano stopniową, ale i znaczną poprawę funkcji ruchowych, które utrzymywały się do 18 lat po przeszczepie (Rys. 2.). Z punktu widzenia większości pacjentów trudno to uznać za sukces, ale dla badaczy był to jasny sygnał, że terapia z zasady działa, a jeżeli udoskonali się technikę i procedury z nią związane to może być znacznie skuteczniejsza.
Poniższy rysunek pokazuje utrzymywanie się wyniku skali motorycznej UPDRS na relatywnie tym samym poziomie przez prawie dwie dekady, nie stosując przy tym lewodopy. Warto podkreślić , że sprawność motoryczna pacjentów co prawda poprawiła się, ale nie wzrosła do poziomu sprzed diagnozy. Zaś sam proces zagnieżdżenia się komórek zajął kilka miesięcy.
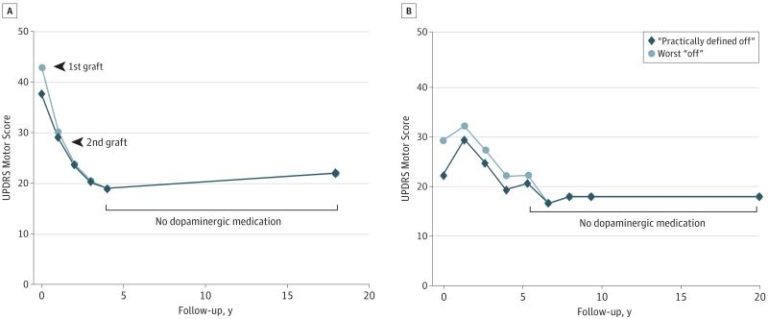
Rys. 2. Wyniki skali UPDRS dwóch pacjentów po interwencji chirugicznej
Kolejne dwa badania, które miały miejsce w Stanach Zjednoczonych, zakończyły się jednak fiaskiem, czego skutkiem było zawieszenie projektu na wiele lat. Jednym z negatywnych aspektów były występujące u znacznej części pacjentów dyskinezy. Wśród przyczyn odpowiedzialnych za taką rozbieżność między wynikami badań wymienia się: różny wiek pacjentów, zaawansowanie choroby, jakość pobieranych próbek, nieodpowiednia technika wszczepienia komórek, inny przedział czasowy mierzenia oraz różny sposób szacowania wyników.
W latach ’90-tych grupa TransEuro postanowiła ostatecznie odpowiedzieć na pytanie czy komórki pobierane z płodów mają rzeczywiście potencjał zastąpienia brakujących komórek. Profesor Barker, kierownik naukowy przedsięwzięcia, twierdzi, że co do zasady to taka terapia jest skuteczną metodą pozbycia się symptomów ruchowych, ale nie będzie ona nigdy wprowadzona na rynek. Przyczyną takiego stanu rzeczy nie są bynajmniej rozterki natury etycznej, przynajmniej nie są one głównym problemem. Na drodze stoi bowiem inny, niemożliwy do rozwiązania problem dysproporcji między liczbą osób z chP a dostępnością komórek pobieranych z płodów. Innymi słowy występuje stały niedobór dawców z których można by pobrać potrzebne komórki.
Aby zebrać potrzebną ilość materiału do uzupełnienia jednostronnych ubytków substancji czarnej należy wykonać około 3-4 aborcji. Wiedząc, że tylko w Europie jest ponad 1,2 miliona osób z chP, liczba zabiegów potrzebnych do zebrania materiału musiała by być co najmniej sześciokrotnie większa. O skali problemu przekonał się projekt TansEuro, który w 2015 zakładał przeprowadzenie 80 przeszczepów. Jednak z powodu braku materiału przeprowadzono tylko 10 operacji obustronnych i jeden zabieg jednostronny. Projekt zakończył się w 2021 roku a jego wyniki ukażą się najpewniej niebawem.
Nad czym pracuje się obecnie
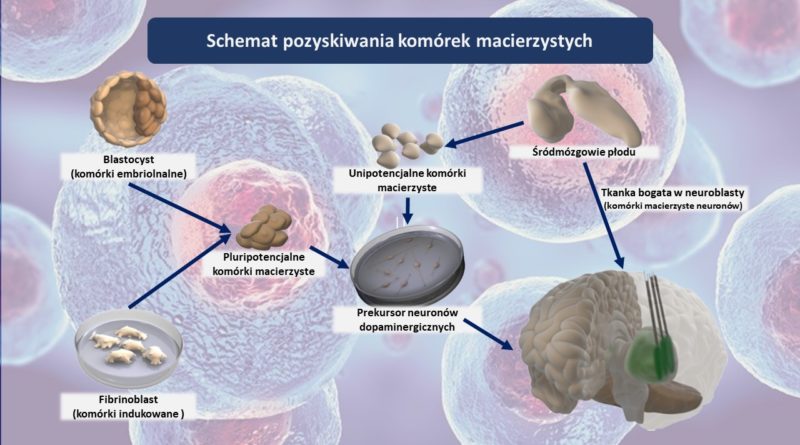
Na podstawie powyżej opisanych badań i szeregu testów przeprowadzonych na zwierzętach przyjmuje się, że skuteczne wszczepienie komórek, które mogły by wypełnić ubytki powstałe na skutek chP, jest jak najbardziej możliwe. Skoncentrowano się więc na znalezieniu innego źródła komórek zdatnych do przeszczepu i tak dochodzimy do komórek macierzystych. Obecnie rozważane są dwa rozwiązania.
• Komórki macierzyste pochodzenia embrionalnego
• Indukowane pluripotencjalne komórki macierzyste – IPSCs (ang. Induced Pluripotent Stem Cells)
Embrionalne komórki macierzyste
Komórki takie pozyskuje się m.in. podczas leczenia bezpłodności metodą in-vitro. Zwykle ilość zapłodnionych komórek tworzonych tą metodą jest większa niż wartość, którą podaje się kobiecie i właśnie te nadprogramowe zarodki mogą być źródłem komórek macierzystych. Sposób ten nie rozwiązuje oczywiście problemu etycznego wykorzystywania ludzkich embrionów, a jedynie sprawia że wydaje się mniej kontrowersyjny. Jednak jego zdecydowaną zaletą jest łatwiejsza dostępność do materiału i relatywnie niska cena terapii, nieco ponad £23 000, co daje rzeczywiste szanse na wprowadzenie leczenia do kanonu obecnie dostępnych opcji.
Do zalet tej terapii należy zaliczyć także jakość wychodowanych komórek. Kształtując je bowiem w laboratoryjnych warunkach możemy mieć pełną kontrolę nad przebiegiem niezbędnych procesów. Wadą tej metody jest to, że tworzenie komórek nerwowych uzależnione jest od naszej wiedzy i jeżeli nie zostaną wzięte pod uwagę wszystkie niezbędne czynniki wówczas możemy otrzymać coś co tylko wygląda na komórkę dopaminergiczną a w rzeczywistości jest czymś innym.
Indukowane pluripotencjalne komórki macierzyste - IPSC
Możliwość przeprogramowania własnych komórek to odkrycie z 2006, za które sześć lat później John B. Gurdon z uniwersytetu w Cambridge i Shinya Yamanaka z uniwersytetu w Kyoto otrzymali nagrodę Nobla w dziedzinie medycyny.
Odkrycie to dowodzi, że jeżeli umieścimy dowolną komórkę w odpowiednim środowisku to można ją przekształcić z powrotem w komórkę macierzystą a następnie w komórkę nerwową. Rozwiązuje to problem etyczny a także docelowo pozwoli używać komórek pacjenta. Jest to tzw. przeszczep autogeniczny, czyli materiał pobierany jest od tej samej osoby, której następnie wszczepia się pobrane i zmodyfikowane komórki. Zaletą tej procedury jest to, że w przeciwieństwie do przeszczepów allogenicznych, pacjent najprawdopodobniej nie będzie musiał brać leków zapobiegających odrzutom przeszczepów a zatem nie ucierpi na tym system odpornościowy.
Wyzwaniem może być fakt, że wszczepiamy pacjentowi jego komórki, które niosą większe ryzyko nawrotu patologii. Ponadto proces zmian, który musi przejść komórka, jest na chwilę obecną nieopłacalny, gdyż wynosi około 4 miliony funtów za zabieg. Dlatego w Japonii tworzy się swoiste banki dla przechowywania komórek od dawców aby w ten sposób obniżyć koszty. Jednak na chwilę obecną komercjalizacja tego podejścia wydaje się być bardziej odległa niż komórek embrionalnych.
Komórkowa Turystyka
Obecnie setki jeśli nie tysiące klinik na całym świecie oferuje możliwość dożylnego podania mezenchymalnych komórek macierzystych, zapewniając o natychmiastowej poprawie stanu zdrowia bez względu na to czy jest to chP, choroba Alzheimera czy jakakolwiek inna przypadłość. Nie ma jednak dowodów, że taka terapia rzeczywiście działa w przypadku chorób neurodegeneracyjnych.
Zanim wyjaśnimy sobie dlaczego tak jest kilka słów o samych komórkach. Komórki mezenchymalne, które można znaleźć m.in. w szpiku kostnym, skórze, tkankach chrzęstnej tłuszczowej czy krwi pępowinowej, to komórki multipotencjalne. I rzeczywiście znajdują one zastosowanie w niektórych problemach medycznych tj. białaczka lub rozległe poparzenia skóry. Jednak jeśli chodzi o chorobę Parkinsona to nic nie wskazuje na ich efektywność. Głównym problemem jest bowiem ich przeżywalność, która nie przekracza kilku dni.
Pomimo tego kliniki bez cienia żenady wyceniają tą usługę na kilka a czasem kilkadziesiąt tysięcy euro. Nie oznacza to jednak, że komórki nie robią zupełnie nic. W badaniach laboratoryjnych wykazują one pewne właściwości ochronne wobec komórek nerwowych, ale wyniki prac przeprowadzonych na gryzoniach nie mogą być uznane za wystarczająco przekonywujący dowód. Pomijając oczywisty fakt, że mysz laboratoryjna to nie człowiek, ważniejszym wydaje się być to, że tylko u ludzi występuje choroba Parkinsona, której patofizjologii tak do końca nie znamy. Umiemy jedynie chemicznie wywołać podobne w skutku ubytki dopaminy. W związku z powyższym nie będzie nadmierną przesadą, jeśli wnioski oparte jedynie na wynikach laboratoryjnych eksperymentów porównamy do zgadywania maści konia po kopytach. Innymi słowy poddanie się takiej procedurze, choć najpewniej bezpieczne, należy traktować jak wątpliwej próby eksperyment na samym sobie za który płacimy komuś innemu.
Jeśli chodzi o etykę postępowania tych klinik to w świetle powyższych informacji nie trzeba chyba nic dodawać. Z kolei o jej efektywności profesor Barker powiedział, że są to zabiegi, które jeśli nie zaszkodzą to na pewno nie pomogą.
Zatem czy warto czekać
Od pierwszych prób klinicznych, przeprowadzonych prawie pięć dekad temu, dokonał się ewidentny postęp w dziedzinie terapii komórkami macierzystymi. Udane implantacje są dowodem słuszności strategii zastępowania komórek a do niedawna głównym problemem było efektywne pozyskiwanie materiału do przeszczepu, gdyż pomimo udokumentowanej skuteczności komórek pobranych z płodu nie jest możliwe ich komercyjne wykorzystanie. Ludzkie neurony dopaminergiczne pochodzenia embrionalnego czy komórki indukowane z dojrzałych komórek pacjenta lub dawcy mogą być odpowiedzią na problem dostępności materiału. Tak przynajmniej myślą potentaci rynku farmakologicznego, którzy przez trzy lata, między 2015 a 2018, zainwestowali w projekt komórek macierzystych w chP, ponad miliard dolarów. Ponadto istnieje jeszcze sprawa bezpieczeństwa przeszczepów i ich ostatecznej ceny, ale determinacja firm inwestujących w tą terapię pozwala zakładać, że komercjalizacja terapii komórkami macierzystymi to kwestia czasu. Niemniej jednak powinniśmy liczyć ów czas raczej w latach może nawet dekadzie aniżeli w miesiącach.
Materiały Źródłowe
Cambridge Neuroscience. (2021, May 12). Cambridge Neuroscience – Roger Barker – Can we repair the Parkinsonian Brain with cell therapies? YouTube. https://www.youtube.com/watch?v=0nghbm0ZQGM&t=2366s
Cure Parkinson’s. (2016, April 13). Professor Roger Barker – Stem Cell Therapies for Parkinson’s – CPT Research Update meeting. YouTube. https://www.youtube.com/watch?v=2LglzkCAUtI&t=1360s
Cure Parkinson’s. (2016a, April 12). Dr Mariah Lelos – Stem Cell Therapy – The Cure Parkinson’s Trust Research Update. YouTube. https://www.youtube.com/watch?v=cjXo1t3W4qw
Cure Parkinson’s. (2016b, April 13). Professor Roger Barker – Stem Cell Therapies for Parkinson’s – CPT Research Update meeting. YouTube. https://www.youtube.com/watch?v=2LglzkCAUtI&t=1360s
Cure Parkinson’s. (2019, June 13). Webinar: Stem Cell Based Therapy for Parkinson’s Disease. YouTube. https://www.youtube.com/watch?v=DcwaFCuR668
Cure Parkinson’s. (2021, March 3). Professor Roger Barker, The John Van Geest Centre for Brain Repair. YouTube. https://www.youtube.com/watch?v=FlG_2XzqMRw&t=803s
International Society for Stem Cell Research (ISSCR). (2020, July 13). wHolistic!TM – Cell Therapies for Parkinson’s: Where are we now? – Roger Barker, PhD. YouTube. https://www.youtube.com/watch?v=Xw0IvVLvg0s
Jang, S. E., Qiu, L., Chan, L. L., Tan, E. K., & Zeng, L. (2020). Current status of stem cell-derived therapies for Parkinson’s disease: from cell assessment and imaging modalities to clinical trials. Frontiers in Neuroscience, 1077.
Kefalopoulou, Z., Politis, M., Piccini, P., Mencacci, N., Bhatia, K., Jahanshahi, M., … & Foltynie, T. (2014). Long-term clinical outcome of fetal cell transplantation for Parkinson disease: two case reports. JAMA neurology, 71(1), 83-87.
Lindvall, O. (2015). Treatment of Parkinson’s disease using cell transplantation. Philosophical transactions of the royal society B: biological sciences, 370(1680), 20140370.
Madrazo, I., Drucker-Colín, R., Díaz, V., Martínez-Mata, J., Torres, C., & Becerril, J. J. (1987). Open microsurgical autograft of adrenal medulla to the right caudate nucleus in two patients with intractable Parkinson’s disease. New England Journal of Medicine, 316(14), 831-834.
Sullivan, W. (1987, April 2). Transplant brings dramatic gains for 2 parkinson’s victims. The New York Times. Retrieved February 6, 2022, from https://www.nytimes.com/1987/04/02/us/transplant-brings-dramatic-gains-for-2-parkinson-s-victims.html