Lewodopa a praca żołądka
Lewodopa a praca żołądka
Zaburzenia żołądkowo-jelitowe należą do najczęstszych, niemotorycznych objawów choroby Parkinsona (chP) i mogą wystąpić nawet na 20 lat przed pojawieniem się klasycznej triady, czyli: spowolnienia ruchów, sztywności mięśni i drżenia spoczynkowego. Ponadto według amerykańskiej bazy danych w przeciągu 4 lat od diagnozy problemy przewodu pokarmowego pojawiają się u około 65% chorych a ich przykłady przedstawia rysunek 1.
Ogólnie rzecz ujmując prowadzi to do zaburzenia procesów przyswajania wartości odżywczych, niedożywienia i utraty masy ciała. W konsekwencji pogarsza się ogólna sprawność fizyczna i obniża się jakość życia [1].
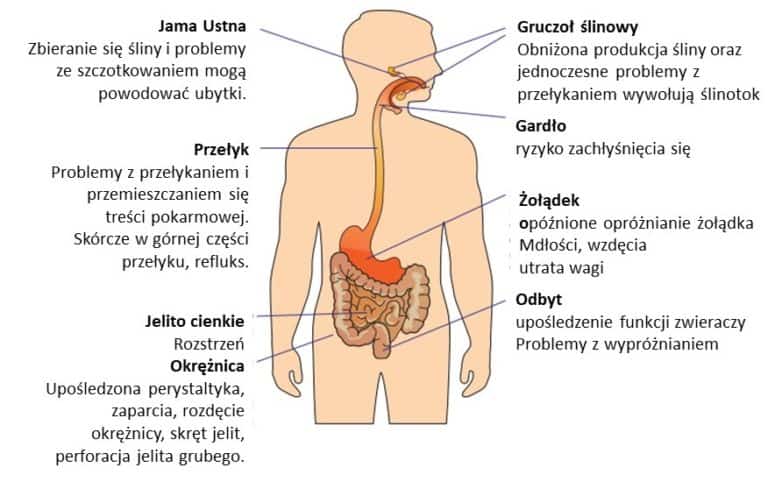
Rys.1. Problemy układu pokarmowego w chorobie Parkinsona
Źródło: Pfeiffe R.(2020) Clinical implications of gastric complications on levodopa treatment in Parkinson’s disease
Wchłanianie Lewodopy
Na wchłanianie lewodopy wpływa wiele czynników m.in. sama choroba, która według hipotezy Braaka intensywnie penetruje jelitowy układ nerwowy będący częścią autonomicznego układu nerwowego.
Jedną z manifestacji tego problemu jest opóźnione przesuwanie się treści żołądkowej tzw. gastropareza. Pozostaje to w bezpośrednim wpływie na ilość absorbowanego leku, który, aby być wchłonięty, musi trafić przynajmniej do dwunastnicy. Czas ten jest tym istotniejszy, że połowa dawki lewodopy/karbidopy lub benserazydu ulega biodegradacji w około 90 minut [1]. Zatem zwłoka na poziomie żołądka przyczynia się do nieadekwatnego stężenia lewodopy w krwioobiegu a to może być odczuwalne jakoby lek w ogóle nie działał. Wówczas zdarza się, że sięgamy po kolejną tabletkę co powoduje przedawkowanie i kolejne problemy.
Gastropareza
Zaburzenie polegające na opóźnionym opróżnianiu żołądka, czyli gastroparezie to jeden z problemów z zakresu perystaltyki. Autorzy artykułu z 2020 roku pt.: „Clinical implications of gastric complications on levodopa treatment in Parkinson’s disease [a]” powiązali to zaburzenie ze słabszą absorbcją lewodopy, robiąc je przynajmniej częściowo odpowiedzialnym za nieregularną odpowiedź na terapię.
Do objawów tej przypadłości zalicza się m.in.: nudności, wymioty, wzdęcia lub odczucie wczesnej sytości podczas posiłku, ból brzucha i spadek wagi. Zaś do formalnego postawienia diagnozy wykonuje się badanie scyntygraficzny oceny pracy żołądka, które polega na podaniu posiłku z radioaktywnym izotopem, aby zmierzyć prędkość przemieszczającej się treści [2] (rys 2).
Problem ten w ogóle populacji dotyczy jedynie 0,2%, ale już u cukrzyków typu 1 i2 wskaźnik ten rośnie odpowiednio do 5% i 1%. Niestety brak jest wymiernych badań dotyczących choroby Parkinsona, ale na podstawie skromnej liczby wyników szacuje się, że zaburzenie to może dotyczyć 70-100% chorych [3].
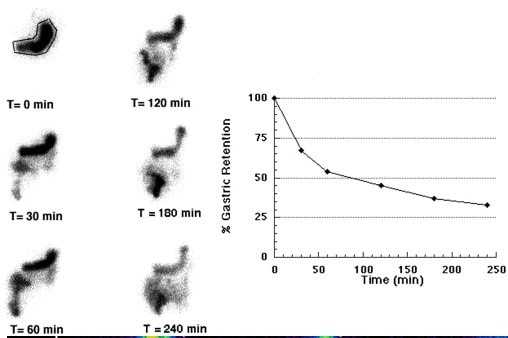
Rys.2. Przykładowy obraz z badania ,funkcji żołądka wraz ze skalą wskazującą czas i procent opróżnienia
Źródło: Friedenberg, F. K., & Parkman, H. P. (2005). Management of delayed gastric emptying. Clinical Gastroenterology and Hepatology, 3(7), 642-646.
Helicobacter pylori
Poza samą chorobą czynnikiem wpływającym na funkcjonowanie żołądka jest obecność patogenu – bakterii H. pylori. Jej występowanie u chorych z Parkinsonem szacuje się na 32-70% i jest to 2-3 razy częściej niż w ogóle populacji. Helicobacter pylori bytując w żołądku obniża jego kwasowość czego konsekwencją są m.in. zapalenie żołądka lub wrzody; zaś same objawy zakażenia mogą być podobne do gastroparezy. Obecność patogenu można zdiagnozować nieinwazyjnie: za pomocą testu oddechowego, testu na obecność antygenu w próbce kałowej lub testu serologicznego z krwi. Druga opcja to metoda endoskopowa określana jako inwazyjna i jest uważana za „złoty standard”. Pozwala ona nie tylko zdiagnozować stan zakażenia i wyleczenia, ale umożliwia także pobranie próbki, pozwalając określić stan żołądka.
Nad korelacją między H. pylori a wchłanialnością lewodopy dywagowano już od dłuższego czasu, aż w opracowaniu z 2011 stworzonym przez Cochrane, niezależną międzynarodową organizację typu non-profit stwierdzono, że istnieją jedynie ograniczone dowody sugerujące powiązanie między eradykacją patogenu a poprawą działania leku [4].
Stoi to jednak w pewnej opozycji do późniejszych ustaleń, gdzie wskazywano na silną zależność między tymi czynnikami [5]. W jednym z takich badań wzięło udział 82 pacjentów z chP gdzie około jedną trzecią zdiagnozowano pozytywnie w kierunku zakażenia H. pylori. Pacjenci ci mieli znacznie gorsze wyniki całkowite mierząc skalą UPDRS [6]. Po wyleczeniu u 34 pacjentów w 6-tym tygodniu badania zauważono wydłużenie fazy ON średnio o 56 minut zaś już pod koniec, w 12-tym tygodniu, nastąpiło skrócenie fazy OFF o 14-minut. Zaś w konkluzji badania czytamy: „Eradykacja H. pylori poprawia szybkość odpowiedzi na lewodopę, wydłuża fazę ON (działania), wpływając tym samym na funkcję motoryczne i jakość życia. Badanie przesiewowe i leczenie H. pylori nie jest drogie i powinno być rekomendowane chorym z chP, zwłaszcza przy nierównomiernej odpowiedzi na lewodopę[1]”
[1] H. pylori eradication improved levodopa onset time, ON duration, motor severity and quality of life parameters. Screening and eradication of H. pylori is inexpensive and should be recommended in PD patients, particularly those with erratic response to levodopa.
Strategie terapeutyczne
Wyleczenie się z H. pylori to tylko jedna z opcji, która może wpływać na absorbcje; inne rozwiązania nastawione są na niwelowanie skutków bardziej zaawansowanego stadium choroby. Opcje te zostały pogrupowane według strategii.
Inne podawanie lewodopy
Pierwsza z nich opiera się na dostarczeniu lewodopy obchodząc całkowicie lub częściowo przewód pokarmowy. Można tu wyróżnić:
- Plastry z dopaminą
- Apomorfinę
- Lewodopę pod język
- Duodopę
- Lewodopę w areozolu
- Głęboką stymulację mózgu (DBS)
Środki prokinetyczne
Druga opcja to środki stymulujące perystaltykę, naturalne jak i farmakologiczne. Należą do nich: metoklopramid, lek przeciwwymiotny, ale ponieważ zaburza on działanie dopaminy w mózgu nie może być stosowany w chP. Należy także wiedzieć, że nie wszystkie leki przeciwwymiotne działają prokinetycznie, opisywany już wcześniej ondansetron jest takim przykładem.
Domperidon działa podobnie jak metolklopramid, ale nie przekracza bariery krew-mózg. Tym niemniej przy kłopotach z sercem należy skonsultować się z kardiologiem, gdyż podnosi on ryzyko wystąpienia zaburzenie aktywności elektrycznej (wydłużenia odstępu QT) oraz nieregularnej pracy tego organu (arytmii) [7].
Relamorelina
Grelina to białko wytwarzane w żołądku, zwane czasem hormonem głodu, które stymuluje jego działanie. Zaś relamorelina to jego zsyntetyzowana wersja, która znacząco poprawia perystaltykę u pacjentów z cukrzycą typu 1 i 2 czy gastroparezą. Zgodnie z wynikami przeglądu systematycznego i meta-analizy, opracowań naukowych uważanych za najpełniejsze, opublikowanych we wrześniu 2020 roku preparaty oparte na syntetycznej grelinie działają i dobrze tolerowane [8]. Tym niemniej badanie nad efektywnością i bezpieczeństwem relamoreliny wciąż są prowadzone.
Rozwiązania dietetyczne
Białka/Proteiny
Wszyscy wiemy, że spożywanie posiłków bogatych w białko upośledza działanie lewodopy a to ze względu na swoiste „wąskie gardła” przy transporcie leku z jelita do krwioobiegu oraz ponownie przy przekraczaniu bariery krew-mózg. Nie możemy ich jednak radykalnie ograniczyć, gdyż białka to zbyt istotny składnik, zbyt wielu procesów. Co ciekawe badania z 2016 roku sugerują osobom starszym spożywanie ich nawet więcej niż przeciętna osoba [9]. Z drugiej jednak strony zmniejszone spożycie białka u 30–90% pacjentów z chP wykazały zmniejszenie uciążliwych wahań funkcji motorycznych [1]. Jednak taka restrykcja wiąże się z ryzykiem niedożywienia, utraty masy mięśniowej i upośledzenia ich funkcjonalności (sarkopenią). Znajdując się między Scyllą a Charybdą najlogiczniejszym wyjściem wydaje się dobrze zbilansowany plan żywieniowy z założeniem ewentualnego „nadgonienia” braków proteinowych w godzinach wieczornych, kiedy to funkcje motoryczne nie są już tak potrzebne.
Błonnik, tłuszcze i spacer
Wiemy, że błonnik jest potrzebny, aby stymulować ruchy naszych jelit, ale w przypadku opóźnionego opróżniania żołądka ma on tą właściwość, że podobnie jak tłuszcze wydłuża znacznie jego pracę. Według Amerykańskiego Instytutu Diabetologii Perystaltyki i Chorób Nefrologicznych korzystne są mniejsze, ale częstsze posiłki z dobrze ugotowanych i powoli konsumowanych produktów, po którym zaleca się spacer jako stymulator perystaltyki.
Zioła i przyprawy od zawsze były uznawane jako ważny element procesów trawiennych. Pomimo obecności na rynku Iberogastu i zaawansowanych prac nad Rikkunshito’u [10], mieszanki ziół na bazie japońskiej medycyny tradycyjnej, brak jest wciąż przekonywujących dowodów potwierdzających ich właściwości na gastroparezę [11]. Zaś aperitif działa wręcz odwrotnie do założenia, nawet 50 ml umeshu, tradycyjnego likieru śliwkowego, znacząco spowolni pracę żołądka [12]. Jednak to co ma także niebagatelne znaczenie to dostarczanie odpowiedniej ilości płynów (około 2 litrów dziennie) a różnego rodzaju ziołowe napary doskonale się do tego nadają.

Rys. 3 . Rikkunshito produkt Japońskiej medycyny tradycyjnej – Kampo
Będąc już przy temacie absorpcji leków i płynów to zaleca się popijanie lewodopy wodą gazowaną z sokiem z cytryny. Bąbelki pomogą rozeprzeć ścianki żołądka zaś 30 ml soku z cytryny stworzy korzystniejsze środowisko do wchłaniania się tabletki [13] [14].
Interwencje chirurgiczne
Są jeszcze możliwości interwencji chirurgicznej a jedną z nich jest wprowadzenie rozrusznika żołądka, działającego na podobnej zasadzie do rozrusznika serca. Operacja trwa około godziny i polega na zainstalowaniu dwóch elektrod i rozrusznika wielkości dużego męskiego zegarka pod skórę. I choć opcja niebrania kolejnego leku w zamian za godzinną interwencję brzmi obiecująco to należy dokładnie przepytać lekarza o wyniki danej placówki, gdyż niektóre z nich odnotowywały poprawę zaledwie w 43% przypadków [15].
[a] Kliniczne implikacja komplikacji gastrycznych w stosowaniu lewodopy w chorobie Parkinsona
[b] H. pylori eradication improved levodopa onset time, ON duration, motor severity and quality of life parameters. Screening and eradication of H. pylori is inexpensive and should be recommended in PD patients, particularly those with erratic response to levodopa.
Bibliografia
[1] R. Pfeiffer R. F. Isaacson S. H. & Pahwa, “Clinical implications of gastric complications on levodopa treatment in Parkinson’s disease,” Parkinsonism & Related Disorders, 2020.
[2] Camilleri M. Parkman H. P. Shafi M. A. et al., “Clinical guideline: management of gastroparesis,” The American journal of gastroenterology, vol. 108, no. 1, p. 18, 2013.
[3] Mukherjee A. Biswas A. & Das S.K., “Gut dysfunction in Parkinson’s disease.,” World journal of gastroenterology, vol. 22, no. 25, p. 5742, 2016.
[4] Rees K. Stowe R. Patel S. Ives N. et al., “Helicobacter pylori eradication for Parkinson’s disease,” Cochrane Database of Systematic Reviews, vol. 11, 2011.
[5] Tan A. H. Mahadeva S. Marras C. Thalha A. M. et al., “Helicobacter pylori infection is associated with worse severity of Parkinson’s disease,” Parkinsonism & related disorders, vol. 21, no. 3, pp. 221-225, 2015.
[6] H. Y. N. W. e. a. Hashim H. Azmin S. Razlan, “Eradication of Helicobacter pylori infection improves levodopa action, clinical symptoms and quality of life in patients with Parkinson’s disease.,” PLoS One, vol. 9, no. 11, p. e112330, 2014.
[7] Mukherjee A. Biswas A. & Das S.K., “Gut dysfunction in Parkinson’s disease.,” World journal of gastroenterology, vol. 22, no. 25, p. 5742, 2016.
[8] Hong S. W. Chun J. Kim J. Lee J. et al., “Efficacy and safety of ghrelin agonists in patients with diabetic gastroparesis: a systematic review and meta-analysis.,” Gut and liver, vol. 14, no. 5, p. 589, 2020.
[9] Baum J. I. Kim I. Y. & Wolfe R., “Protein consumption and the elderly: what is the optimal level of intake?,” Nutrients, vol. 8, no. 6, p. 359, 2016.
[10] Yamaguchi H. Kimura Y. Imamura M. Nagayama M. et al., “Effect of Rikkunshito, a Traditional Japanese Herbal Medicine, on Delayed Gastric Emptying and Oral Dietary Intake After Pancreaticoduodenectomy: A Prospective, Randomized, Single-Center, Open-Labeled Study.,” Clinical and Experimental Gastroenterology, vol. 13, p. 577, 2020.
[11] Fifi A. C. Axelrod C. H. Chakraborty P. Saps M., “Herbs and spices in the treatment of functional gastrointestinal disorders: A review of clinical trials,” Nutrients, vol. 10, no. 11, p. 1715, 2018.
[12] Inamori M. Iida H. Endo H. Hosono K. et al., “Aperitif effects on gastric emptying: a crossover study using continuous real-time 13 C breath test (BreathID System).,” Digestive diseases and sciences, vol. 54, no. 4, pp. 816-818, 2009.
[13] Yazawa I. Terao Y. Sai I. Hashimoto K. & Sakuta M., “Gastric acid secretion and absorption of levodopa in patients with Parkinson’s disease–the effect of supplement therapy to gastric acid,” Rinsho shinkeigaku= Clinical neurology, vol. 34., no. 3, pp. 264-266., 1994.
[14] Karbowniczek A. Sienkiewicz-Jarosz H. Czernuszenko A. et al., “Leczenie żywieniowe w neurologii — stanowisko interdyscyplinarnej grupy ekspertów,” Polski Przegląd Neurologiczny, vol. 14, no. 3, pp. 117-130, 2018.
[15] Usai-Satta P. Bellini M. Morelli O. Geri F., “Gastroparesis: New insights into an old disease,” World Journal of Gastroenterology, vol. 26, no. 19, p. 2333, 2020.