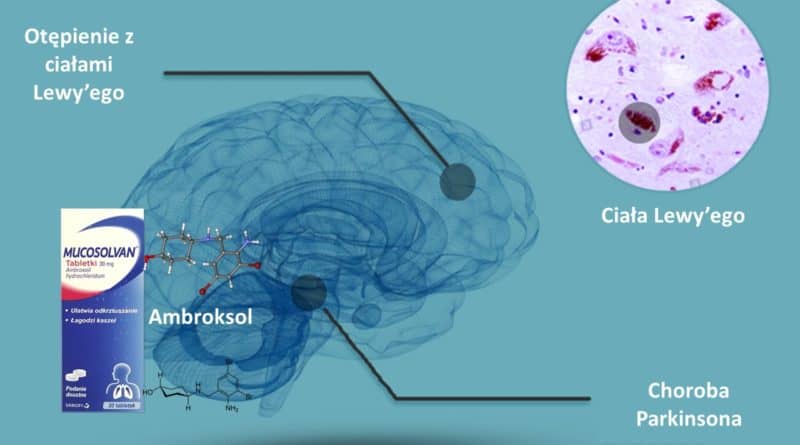
Ambroksol w chorobie Parkinsona
Ambroksol w chorobie Parkinsona
Ambroksol [opis substancji – mp.pl] to doustny lek na kaszel, dostępny bez recepty, który od pewnego czasu jest poważnie rozważany jako potencjalna substancja mogąca wpłynąć na przebieg choroby Parkinsona. Z początkiem tego roku na stronach CureParkinson’s [link do artykułu] pojawiła się informacja o badaniu mogącym ostatecznie potwierdzić bądź wykluczyć jego rolę w chorobach neurodegeneracyjnych. Badanie ma na celu odpowiedzieć na pytanie, czy ambroksol, w odpowiednio wysokim stężeniu, może wspomóc funkcje enzymu (β-glukocerebrozydazy) biorącego udział w procesach utylizacji zbędnych produktów przemiany materii w komórkach nerwowych.
Choroba Gauchera a choroba Parkinsona
W rozważanym przypadku przyczyną słabo działającego enzymu jest mutacja genu GBA, która jest podstawą choroby Gauchera i być może mieć swój udział w chorobie Parkinsona. Pomimo że w chP nie ma jasnej podstawy genetycznej, to istnieją korelacje między występowaniem mutacji GBA a częstotliwością występowania chP. Zauważono bowiem, że osoby z mutacją cechującą chorobę Gauchera 20-30 razy częściej chorują na chP[1]. Ponadto jedną z najczęściej występujących mutacji, którą powiązano z chP, jest właśnie owa skaza. (5-10% przypadków)[2]
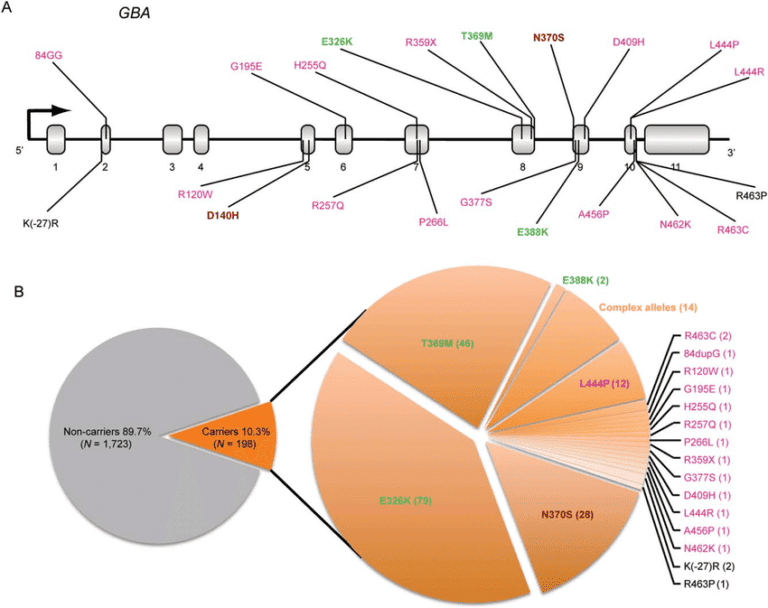
Rys.1. Dystrybucja mutacji w genie GBA wśród pacjentów badanych z chorobą Parkinsona.
10,3% spośród 1 921 analizowanych pacjentów z chorobą Parkinsona było nosicielami mutacji w genie GBA. Lokalizacja mutacji GBA zidentyfikowanych w tej badaniu jest przedstawiona na (A) Mutacje zgłaszane w neuropatycznych typach 2 lub 3 choroby Gauchera są oznaczone czcionką o kolorze magenta. Mutacje związane z łagodnym, nie-neuropatycznym typem 1 choroby Gauchera (np. N370S) są oznaczone brązową czcionką. Warianty ryzyka są oznaczone zieloną czcionką, a te warianty, których fenotyp kliniczny nie jest ustalony, są oznaczone czarną czcionką. Dystrybucja mutacji jest przedstawiona na wykresie kołowym po prawej stronie (B) wraz z liczbą obserwowanych nosicieli. GD oznacza chorobę Gauchera[3].
Źródło: Liu, G. (2016). Annals of neurology
Zaobserwowana korelacja wskazuje, przynajmniej częściowo, że za ubytkiem komórek dopaminergicznych może stać mechanizm podobny w swej patologii do problemu choroby Gauchera. Odkładające się złogi tzw. ciała Lewy’ego mogą być produktem nie dość efektywnie działającego procesu utylizacji. Ich nadmiar z kolei ma niebagatelne znaczenie na prawidłowe funkcjonowanie komórek.
Badania na komórkach
Powyższe spostrzeżenia postanowiono sprawdzić empirycznie, efektem czego była publikacja z 2014 pod przewodnictwem profesora Anthony H.V. Shapira p.t.: ”Ambroxol improves lysosomal biochemistry in glucocerebrosidase mutation-linked Parkinson disease cells”. Badanie polegało na pobraniu komórek skóry od jedenastu osób z mutacjami GBA, w tym niektórych dodatkowo zdiagnozowanych z chorobą Parkinsona. Następnie w pobranym materiale zmierzono funkcjonalność interesującego nas enzymu. Zebrane wyniki potwierdziły tezę o jego zmniejszonej aktywności. Średnia funkcjonalność glukocerebrozydazy, w komórkach osób z chorobą Gauchera, oscylowała na poziomie około 5% aktywności u osób zdrowych. W komórkach osób z chorobą Parkinsona, która została podzielona na tych z mutacją GBA, jak i tych bez niej, efektywność wynosiła odpowiednio 56% i 59%[4] rys.2. Z przeprowadzonego eksperymentu wynikało, że po 5 dniach stosowania ambroksolu poziomy alfa-synukleiny, podstawowego budulca wchodzącego w skład ciał Lewy’ego, zmniejszyły się o 15%.
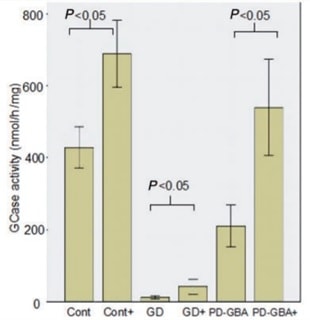
Rys. 2. Interwencja ambroksolem w sposób zanczący zwiększyła aktywność glukocerebrozydazy.
Graf przestawia zwiększenie aktywności enzymu (wyrażonej w jednostkach nmol/mg/h). Cont. – grupa kontrolna , (GD) – choroba Gauchera,(PD-GBA) – choroba Parkinsona z genem GBA. ‘+’ – interwencja ambroksolem
Źródło: McNeill et.al. (2014). Brai
Badania na zwierzętach
Dwa lata później w 2016 opublikowano kolejne wyniki: „Ambroxol effects in glucocerebrosidase and α-synuclein transgenic mice”. Tym razem test przeprowadzony został na myszach. Po okresie 12-tu dni stosowania medykamentu stwierdzono zmniejszenia poziomów alfa-synukleiny w komórkach gryzoni [1]. Wskazywać to może na wydajniejsze usuwanie niepożądanych białek przez komórki nerwowe. Na tej podstawie wywnioskowano, że ambroksol nie tylko przenika do mózgu myszy, ale jego stężenie jest odpowiednio wysokie, by być skutecznym. Inną ważną cechą było to, że badacze nie zaobserwowali poważnych skutków ubocznych.
W roku następnym opublikowano kolejne badanie przeprowadzone na trzech makakach jawajskich. Celem doświadczenia było oszacowanie czy badany środek potrafi przekroczyć barierę krew-mózg u ssaków naczelnych w odpowiednio wysokiej koncentracji, aby wpłynąć na pracę enzymów. Pierwszemu osobnikowi podawano placebo, drugiemu 22,5mg ambroksolu na dobę, trzeciemu zaordynowano lek w dawce 100 mg/dobę. Doświadczenie wykazało, że codzienne podawanie 100 mg/dobę zwiększyło aktywność interesującego nas enzymu w mózgu średnio o 20%. Innym istotnym spostrzeżeniem było to, że dawka 22,5 mg okazała się nieskuteczną[5]. Zauważono także, że ambroksol może mieć wpływ na inne enzymy biorące udział w procesie samooczyszczania się komórki.
Badania na ochotnikach
Następnym krokiem było badanie przeprowadzone na ochotnikach. Wybrano 17 osób z chP, które przez 6 miesięcy przyjmowały 1260 miligrama, co przekładało się na 21 tabletek ambroksolu dziennie. Pierwszych 28 dni zostało przeznaczone na stopniowe zwiększanie dawki zgodnie z poniższym schematem:
3 dawki po 60 mg (dni 1-7),
3 dawki po120 mg (dni 8-14),
3 dawki po 180 mg (dni 15-21)
3 dawki po 300 mg (dni 22-28).
Po tym czasie przez następne 158 dni zaczęto podawać dawkę 1,26 g dziennie (420 mg 3 razy dziennie). Testowano w ten sposób przede wszystkim bezpieczeństwo i tolerancje na lek. Dodatkowo zauważono, że w pobranym od ochotników płynie mózgowo-rdzeniowym wzrost poziomów enzymów o 35% oraz wzrost o 13% stężenia alfa-synukleiny. Sugeruje to zwiększenie efektywności, z jaką komórki usuwały patologiczne białko, przy jednocześnie dobrej tolerancji organizmu na lek. Obiecującym jest też to, że efekty zaobserwowano zarówno u uczestników z mutacją GBA, jak i bez niej[2].
Zmiana ta przełożyła się na wyniki [Tabela 1]. Najbardziej ewidentną zmianę odnotowano w części III skali MDS-UPDRS. Spadek o 6,8 punktów w przedziale 0-56, gdzie zero oznacza brak symptomów, Część III odnosi się do symptomach motorycznych tj.: mimika twarzy, drżenie spoczynkowe, spowolnienie ruchów, chód, sztywność mięśni itp. Ocena funkcji poznawczych, za pomocą skali MoCA, nie uległa znaczącym zmianom. Natomiast pogorszenie odnotowano, jeśli chodzi o symptomy poza motoryczne, mierzone skalą NMSS. Wartości tego testu wzrosły o 11,5 w skali o 0 do 360 punktów[2].
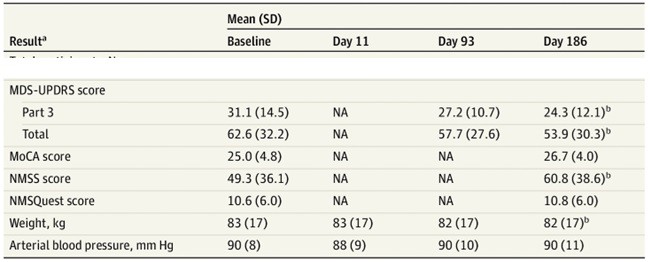
Tabela. 1 Część końcowych wyniki uczestników, którzy ukończyli badanie.
Skróty: GCase, enzym glukocerebrowazydazy; MDS-UPDRS, Skala Zjednoczonych Zaburzeń Ruchowych w Chorobie Parkinsona Stowarzyszenia Chorób Ruchowych; MoCA, Montreal Cognitive Assessment; NA, nie dotyczy; NMSQuest, Kwestionariusz Symptomów Pozamotorycznych; NMSS, Skala Symptomów Pozamotorycznych. *Kliniczne wskaźniki są rejestrowane w stanie off, czyli bez leku (Madoparu).
Źródło: Mullin, S. et.al., (2020). JAMA neurology
Odnotowane skutki uboczne
Jeżeli idzie o skutki uboczne to nie odnotowano żadnych poważnych działań niepożądanych. Podczas badania wystąpiło 176 działań niepożądanych, spośród których 121 uznano za niezwiązane z lekiem, 32 symptomów uznano za mało prawdopodobne powiązanie, 15 możliwie związane, 5 prawdopodobnie związane, a 3 jednoznacznie związane z leczeniem[2].
Działania niepożądane uznane za prawdopodobnie związane z preparatem interwencyjnym to nudności (1 pacjent), wymioty (2 pacjentów), uczucie pieczenia po połknięciu preparatu interwencyjnego (1 pacjent) i niestrawność (1 pacjent). Jednoznacznie związane działania niepożądane to zgaga (1 pacjent), nudności (1 pacjent) oraz przemijający stan skóry na klatce piersiowej, plecach i ramionach (1 pacjent).[2].
Należy w tym miejscu podkreślić fakt, że badanie to było badaniem otwartym, a więc niewykluczającym efektu placebo. Ponadto 17 osób to bardzo mała grupa i w żadnym wypadku uzyskane wyniki nie mogą być uznane za miarodajne i muszą być traktowane z odpowiednią dozą sceptycyzmu.
Bierzące badania
Ponieważ dotychczasowe rezultaty są dość zadowalające, to z początkiem roku 2023 fundacja Cure Parkinson’s umieściła na swoich stronach informacje na temat planowanej fazy III badania klinicznego, pt.: „Ambroxol to Slow Progression in Parkinson Disease (ASPro-PD)”, do którego w Wielkiej Brytanii trwa obecnie etap rekrutacji [link do rekrutacji].
Z założenia ma to już być próba wiążąca, gdyż weźmie w niej udział 330 pacjentów, losowo przydzielonych do jednej z dwóch grup. Założenie z grubsza jest takie, że jedna z grup będzie przyjmować lek stopniowo zwiększany aż do dawki 420mg trzy razy dziennie a druga tak samo wyglądające placebo. Eksperyment potrwa 104 tygodnie, czyli ponad 2 lata i podczas jego trwania nikt, włączając to personel medyczny, nie będzie wiedział, kto dostaje lek a kto placebo. Jest to element konieczny, aby zminimalizować ewentualną stronniczość, która może wpłynąć na końcowy wynik [NCT05778617 – link do badania].
Analizując dotychczasowe rezultaty i ambitny cel spowolnienia przebiegu choroby Parkinsona, wartym wydaje się śledzenie tego przedsięwzięcia. I to nie tylko dlatego, że jest to jeden z niewielu leków mogących spowolnić chorobę, ale co istotne, jest to już trzeci, czyli ostatni etap przed wprowadzeniem leku na rynek. Z reguły w etapie tym zakłada się, że dana substancja ma już pewien sprawdzony efekt i jest bezpieczna. Teraz ostatnim już celem jest oszacowanie dokładnego wpływu danej interwencji. Co prawda i na tym etapie wiele może się wydarzyć, gdyż pozytywny wynik a co za tym idzie wprowadzenie leku na rynek, jest osiągalny w nieco ponad połowie przypadków, ale statystyczne 57%[6] szans na lek mogący spowolnić chorobę Parkinsona to już całkiem sporo.
Bibliografia
[1] Migdalska‐Richards, A., Daly, L., Bezard, E., & Schapira, A. H. (2016). Ambroxol effects in glucocerebrosidase and α‐synuclein transgenic mice. Annals of neurology, 80(5), 766-775. [link]
[2] Mullin, S., Smith, L., Lee, K., D’Souza, G., Woodgate, P., Elflein, J., … & Schapira, A. H. (2020). Ambroxol for the treatment of patients with Parkinson disease with and without glucocerebrosidase gene mutations: a nonrandomized, noncontrolled trial. JAMA neurology, 77(4), 427-434. [link]
[3] Liu, G., Boot, B., Locascio, J. J., Jansen, I. E., Winder‐Rhodes, S., Eberly, S., … & Nalls, M. A. (2016). Specifically neuropathic Gaucher’s mutations accelerate cognitive decline in Parkinson’s. Annals of neurology, 80(5), 674-685.[link]
[4] McNeill, A., Magalhaes, J., Shen, C., Chau, K. Y., Hughes, D., Mehta, A., … & Schapira, A. H. (2014). Ambroxol improves lysosomal biochemistry in glucocerebrosidase mutation-linked Parkinson disease cells. Brain, 137(5), 1481-1495.[link]
[5] Migdalska‐Richards, A., Ko, W. K. D., Li, Q., Bezard, E., & Schapira, A. H. (2017). Oral ambroxol increases brain glucocerebrosidase activity in a nonhuman primate. Synapse, 71(7), e21967.[link]
[6] BIO, Q. (2011). Informa Pharma Intelligence. Clinical Development Success Rates and Contributing Factors, 2020, 2021. [link]